NA代表阿伏加德罗常数,下列说法正确的是( )
A.同一物质的固、液、气三种状态的熵相同
B.0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.3NA个电子转移
C.等物质的量的钠分别在足量的氧气和氯气中燃烧,转移电子数相等
D.1.5 mol NO2与足量H2O反应,转移的电子数为2NA
知识点:物质的量的计算
C
考点:阿伏加德罗常数.
分析:A.固态时熵值最小,气态时熵值最大;
B.先判断过量,然后根据不足量计算出转移的电子数目;
C.根据电子守恒进行判断;
D.二氧化氮既是氧化剂也是还原剂,1.5mol二氧化氮与水反应生成1mol硝酸.
解答:解:A.同种物质在固态、液态、气态三种状态下,固态时熵值最小,气态时熵值最大,故A错误;
B.0.1mol铁完全反应需要消耗0.15mol氯气,氯气不足,反应转移的电子按照氯气的物质的量计算,0.1mol氯气完全反应转移0.2mol电子,转移的电子数为0.2NA,故B错误;
C.等物质的量的钠分别在足量的氧气和氯气中燃烧,钠失去的电子的物质的量相等,转移的电子数相等,故C正确;
D.1.5 mol NO2与足量H2O反应,生成1mol硝酸,转移1mol电子,转移的电子数为NA,故D错误.
故选C.
点评:本题考查了阿伏伽德罗常数,注意过氧化钠与水的反应、二氧化氮与水的反应,既是氧化剂也是还原剂,本题难度不大.
下列各组离子,能在指定溶液中大量共存的是( )
①无色溶液中:K+、Cl﹣、Na+、HCO3﹣、OH﹣
②使pH试纸变深蓝的溶液中:K+、CO32﹣、Na+、AlO2﹣
③水电离的c(H+)=10﹣12mol/L的溶液中:ClO﹣、CO32﹣、NO3﹣、NH4+、SO32﹣
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl﹣、Na+、SO42﹣
⑤使甲基橙变红的溶液中:MnO4﹣、NO3﹣、SO42﹣、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO3﹣、Cl﹣.
A.①③④ B.②④⑤ C.①②⑤ D.②③⑥
知识点:离子共存
B
考点:离子共存问题.
专题:离子反应专题.
分析:根据离子之间不能结合生成水、气体、沉淀、弱电解质等,不能发生氧化还原反应,则能大量共存,以此来解答.
解答:解:①HCO3﹣、OH﹣结合生成水和碳酸根离子,不能共存,故错误;
②使pH试纸变深蓝的溶液,显碱性,该组离子之间不反应,能共存,故正确;
③水电离的c(H+)=10﹣12mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在ClO﹣、CO32﹣、SO32﹣,碱溶液中不能大量存在NH4+,故错误;
④加入Mg能放出H2的溶液,显酸性,该组离子之间不反应,能共存,故正确;
⑤使甲基橙变红的溶液,显酸性,该组离子之间不反应,能共存,故正确;
⑥pH=0的溶液,显酸性,Fe2+、H+、NO3﹣发生氧化还原反应,不能共存,故错误;
故选B.
点评:本题考查离子的共存,为高考常见题型,侧重信息的抽取和离子之间反应的考查,注重学生思维严密性的训练,有利于提高学生分析问题解决问题的能力,题目难度不大.
根据表中信息判断,下列选项错误的是( )
反应序号
反应物
产物
①
KMnO4、H2O2、H2SO4
K2SO4、MnSO4…
②
Cl2、FeBr2
FeCl3、FeBr3
③
MnO4﹣…
Cl2、Mn2+…
A.反应①的其余产物为H2O和O2
B.反应②中Cl2与FeBr2的物质的量之比为1:2
C.反应③中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱的顺序为Cl2>MnO4﹣>Br2
知识点:氧化还原反应
D
考点:氧化还原反应.
专题:氧化还原反应专题.
分析:A.根据元素守恒和电子守恒判断;
B.②中溴元素的化合价没有变化,即Cl2只将Fe2+氧化,根据化合价变化判断;
C.③中MnO4﹣被还原成Mn2+,则Cl﹣被氧化为Cl2,据此判断;
D.根据氧化剂的氧化性大于氧化产物的氧化性判断.
解答:解:A.Mn元素被还原,故H2O2被氧化,生成O2,则发生的反应为反应为KMnO4+H2O2+H2SO4→K2SO4+MnSO4+O2↑+H2O,故A正确;
B.②中溴元素的化合价没有变化,即Cl2只将Fe2+氧化,则发生的反应为:3Cl2+6FeBr2=2FeCl3+4FeBr3,则Cl2与FeBr2的物质的量之比为1:2,故B正确;
C.③中MnO4﹣被还原成Mn2+,则Cl﹣被氧化为Cl2,Cl元素从﹣1价升高到0价,转移的电子数为1,则生成1 mol Cl2,转移电子2 mol,故C正确;
D.③中MnO4﹣被还原成Mn2+,Cl﹣被氧化为Cl2,则氧化性MnO4﹣>Cl2,所以氧化性由强到弱的顺序为MnO4﹣>Cl2>Br2,故D错误.
故选D.
点评:本题考查了氧化还原反应中电子转移和化合价升降之间的关系知识,注意知识的归纳和整理是关键,题目难度中等.
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol•L﹣1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )

A.1:1:4 B.1:3:1 C.3:3:8 D.1:1:1
知识点:铁及其化合物
A
考点:铁的化学性质;有关混合物反应的计算.
专题:图示题;压轴题.
分析:-某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,由图可知,加入1molFe,亚铁离子的浓度的不变,则发生Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,再加入1molFe发生Fe+2Fe3+═3Fe2+,再加铁粉时亚铁离子的浓度增加,发生Fe+Cu2+═Fe2++Cu,以此来解答.
解答:-解:某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,由图可知,加入1molFe,亚铁离子的浓度的不变,
则发生Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,
1 4 1
再加入1molFe发生Fe+2Fe3+═3Fe2+,
1 2 3
所以n(HNO3)=4mol,原溶液中硝酸铁的物质的量n(Fe3+)=2mol﹣1mol=1mol,
再加铁粉时亚铁离子的浓度增加,
发生Fe+Cu2+═Fe2++Cu,
1 1
所以n(Cu2+)=1mol,
即溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为1:1:4,
故选A.
点评:本题考查铁的化学性质,明确图象中每段发生的化学反应是解答本题的关键,注意反应与图象的对应关系来解答,题目有一定难度,特别是溶液中铁离子浓度的判断.
对下列化学用语的理解正确的是( )
A.原子结构示意图 可以表示12C,也可以表示14C
可以表示12C,也可以表示14C
B.比例模型 可以表示二氧化碳分子,也可以表示水分子
可以表示二氧化碳分子,也可以表示水分子
C.电子式 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子
D.分子式C2H4O2可以表示乙酸,也可以表示乙二醇
知识点:化学用语
A
考点:电子式、化学式或化学符号及名称的综合.
专题:化学用语专题.
分析:A.同位素的质子数、核外电子数相同,中子数不同;
B.二氧化碳是直线型分子,水分子在V型分子;
C.氢氧根离子带一个单位的负电荷;
D.乙酸中含有碳氧双键,乙二醇中所有原子都达到饱和.
解答:解:A.同位素的质子数和核外电子数相同,所以其原子结构示意图相同,故A正确;
B.二氧化碳是直线型分子,水分子在V型分子,该比例模型是水分子模型,故B错误;
C.氢氧根离子的电子式为: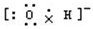 ,羟基的电子式为
,羟基的电子式为 ,故C错误;
,故C错误;
D.乙酸的分子式为:C2H4O2 ,乙二醇的分子式为C2H6O2,故D错误;
故选A.
点评:本题考查化学用语,易错选项是C,注意氢氧根离子和羟基的区别,为易错点.

